Syndrome de Renutrition Inapropriée
On entend par syndrome de renutrition inappropriée (SRI) ou refeeding syndrome, l’ensemble des anomalies biologiques et cliniques qui surviennent lors de la renutrition de patients dénutris ou ayant subi un jeûne prolongé.
Il n'existe pas de critères diagnostiques précis permettant d'unifier le syndrome ce qui explique une fourchette haute d'incidence dans la littérature ( 0,43% Camp et al, étude rétrospective sur 10 197 patients sur 1 an dans 72 centres US, incidence de 0,43 % des hypophosphorémie < 0,33 mmol/L. à 34%
Camp et al, étude rétrospective sur 10 197 patients sur 1 an dans 72 centres US, incidence de 0,43 % des hypophosphorémie < 0,33 mmol/L. à 34% Marik et al, étude monocentrique sur 62 patients, 21 cas d’hypophosphorémie induite par la réalimentation après 48 heures de jeûne.)
Marik et al, étude monocentrique sur 62 patients, 21 cas d’hypophosphorémie induite par la réalimentation après 48 heures de jeûne.)
Survient pour tout type de renutrition avec une mortalité différente traduisant probablement l'importance de la dénutrition sous-jacente : renutrition parentérale (36%), entérale (21%), voire orale (13%).
Qu'est-ce que le syndrome de renutrition inappropriée (SRI) ?
Physiopathologie
Adaptation au jeûne
Le glucose est la source énergétique principale de l’organisme utilisé directement en post-prandiale ou stocké sous forme de glycogène musculaire et hépatique (glycogénosynthèse) et sous forme de triglycérides dans le tissu adipeux.
Lors du jeûne, les réserves de glycogène hépatique (glycogénolyse) et musculaire, sont utilisées en priorité. Après 24 à 72 heures, les réserves sont fortement diminuées et l’organisme passe de l’utilisation du glucose à celle des protéines (néoglucogénése) et des graisses (lipolyse et ß-oxydation). Les corps cétoniques sont l'essentiel des apports énergétiques.
La sécrétion d'insuline diminue alors que la sécrétion de glucagon augmente.
A long terme, on observe une fonte musculaire et des masses grasses avec une diminution du volume cellulaire.
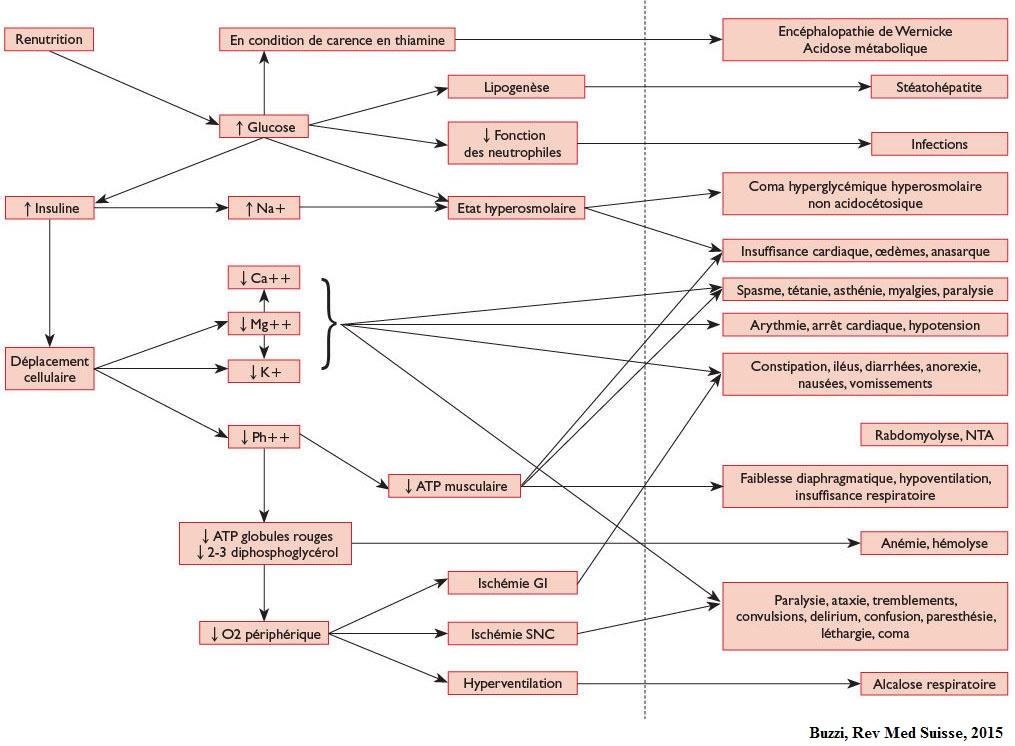
Les taux intracellulaires de potassium, de phosphate, de magnésium et de calcium diminuent car l’énergie intracellulaire est insuffisante à maintenir un pompage ionique actif.
Les réserves de vitamine B1 (thiamine), cofacteur essentiel de l’oxydation du glucose, de la protéolyse, de la production d’acétyl-CoA et du cycle de Krebs sont épuisées en dix à vingt jours.
Une fois l’organisme adapté à ces modifications, la survie peut durer plusieurs mois à condition que le jeûne ne soit pas absolu.
Phase de renutrition
La reprise des apports de glucose réactive la sécrétion d'insuline à l'origine d'un transfert intracellulaire massif de glucose et d’ions (potassium, phosphate, magnésium et calcium) aux dépens du secteur extracellulaire. La reprise des métabolismes énergétiques cellulaires sont également à l'origine de consommation massive d'électrolytiques notamment de phosphore et également de vitamines notamment la thiamine.
Les concentrations plasmatiques d'électrolytes sont abaissées tout en restant un très mauvais reflet des stocks intra-cellulaires (95% des électrolytiques totaux).
Signes cliniques
Le risque d'événements cliniques mortels est le plus fort entre le début de renutrition et les 5 premiers jours puis les troubles peuvent persister plus ou moins intensément par la suite.
Cardiaque:
- Troubles du rythme ventriculaire liées à l'hypokaliémie, hypomagnésémie et hypocalcémie (précocément passage d'une bradycardie souvent présente dans les dénutritions sévères à une tachycardie sinusale, ESV avec sensation de palpitations, torsade de pointe responsable de mort subite).
- Insuffisance cardiaque liée à l'hypophosphorémie et l'hypocalcémie (altération FEVG, choc cardiogénique).
- Rétention hydrosodée et hyperhydratation extracellulaire (œdème, épanchement des séreuses) par sortie de sodium par action de l'insuline sur la Na+/K+ ATPase
Neurologique:
- Hypoglycémie par hyperinsulisnisme inadaptée.
- Encéphalopathie de Gayet Wernicke par déficit en thiamine et surconsommation secondaire à l'apport énergétique.
- Spasmes, tétanie, myalgies (hypomagnésémie, hypocalcémie).
- Rhabdomyolyse, faiblesse musculaire avant jusqu'à une myopathie (hypophosphorémie)
- Neuropathie périphérique avec paresthésie Silvis et al, rapportée à l’hypophosphorémie jusqu’à la polyradiculonévrite mimant un syndrome de Guillain-Barré
 van Eijik et al, anorexique de 46 ans développant une polyneuropathie axonale sur SRI probablement par hypophosphorémie. Réversible après supplémentation
van Eijik et al, anorexique de 46 ans développant une polyneuropathie axonale sur SRI probablement par hypophosphorémie. Réversible après supplémentation  Weintraub ME. 64 ans en phase de renutrition, pseudo-GB réversible en qq semaines avec persistance hyporéflexie
Weintraub ME. 64 ans en phase de renutrition, pseudo-GB réversible en qq semaines avec persistance hyporéflexie - Convulsions et d'EME sont possibles mais semblent être peu fréquents Kameoka et al, 1 cas sur 21 anorexiques présentant un SRI.

- Encéphalopathie allant de la somnolence au coma par œdème cérébral Sundström et al, 49 ans, malnutrition sur gastric bypass.
Respiratoire:
- Polypnée superficielle avant alcalose respiratoire :
- défaut d’oxygénation tissulaire partiellement due à une baisse de la 2,3-diphosphoglycerate (2,3-DPG) érythrocytaire par hypophosphorémie (entraine une déviation vers la droite de la courbe de dissociation de l'hémoglobine avec baisse d'affinité pour l'O2).
- acidose métabolique conséquence de l'acidocétose de jeûne
- Risque d'insuffisance respiratoire liée à l'atteinte diaphragmatique et myopathique hypophosphorémie.
Digestif:
- Altération du transit allant de la constipation (rôle de l'hypokaliémie) au diarrhée.
- Douleurs abdominales
- Nausées, Vomissements
- Stéatohépatite pouvant aller jusqu'à l'insuffisance hépatocellulaire.
Prévention du SRI
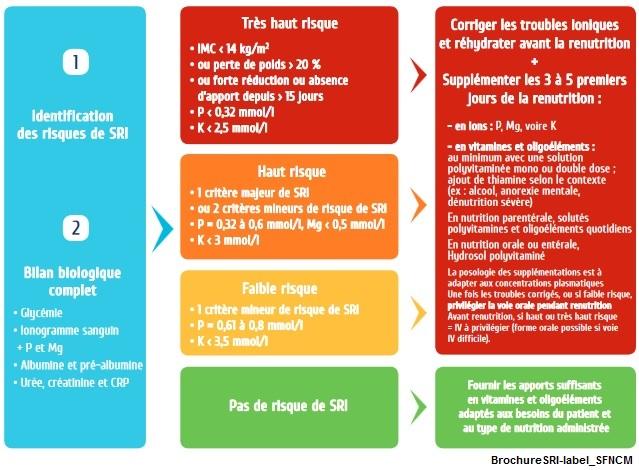
La prévention du SRI repose avant tout sur l'identification des patients à haut risque sur des critères élaborer par l’Institut national pour la santé et l’excellence clinique (NICE) au Royaume-Uni.
Prise en charge
Substitution en électrolytiques et en vitamines
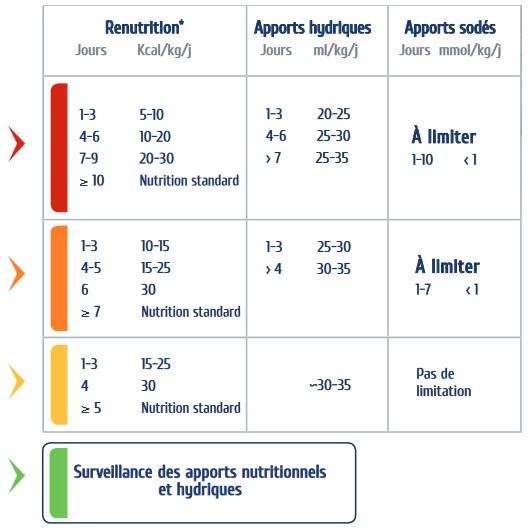
- Les carences en électrolytes (Phosphore, Potassium, Magnésium) sont corrigées et un suivi 2 fois par jour est mis en place jusqu'à stabilisation des compensations.
- Un apport en Thiamine est indispensable en début de traitement. Il n'y a pas de posologie bien définie de 300 à 500 mg par jour pendant 3 à 4 jours selon l'intensité de dénutrition.
- Un apport en oligoéléments et polyvitaminiques pendant les 3 à 4 jours doit être associé en cas de dénutrition profonde.
Renutrition progressive
Les apports caloriques commencent à 5 Kcal/kg/jour avec une répartition 50-60% du total d’origine glucidique, 30-40% lipidiques et 15-20% protéiques.
Les paliers seront augmentés de 5 Kcal/kg/jour tous les 2 à 3 jours selon l'intensité des besoins d'électrolytes jusqu'à 20 Kcal/kg/jour. Une fois les besoins substitutifs stabilisés, les apports alimentaires pourront être adaptées à la cible alimentaire.
Bibliographie
- Marta Buzzi, Alessandro Limonta , Jérôme Stirnemann, Claude Pichard. Syndrome de renutrition inappropriée : aspects pratiques. Rev Med Suisse, 2015, DOI: 10.53738/REVMED.2015.11.490.1886
- Camp MA, Allon M. Severe hypophosphatemia in hospitalized patients. Electrolyte Metab 1990;16:365-8.
- Marik PE, Bedigian MK. Refeeding hypophosphatemia in critically ill patients in an intensive care unit. A prospective study. Arch Surg 1996;131:1043-7.
- Nice guidelines : Nutrition support in adults : Oral nutrition support, enteral tube feeding and parenteral nutrition. www.nice.org.uk/guidance/cg32. 2006.
- Brochure SRI - SFNCM
- van Eijk JJJ, Abdo WF, den Deurwaarder E, Zwarts MJ, van de Warrenburg BPC. [Severe, subacute axonal polyneuropathy due to hypophosphatemia]. Ned Tijdschr Geneeskd. 2010;154:A914.
- Weintraub ME. Hypophosphatemis mimicking acute Guillanin-Barré-Strohl syndrome. A complication of parenteral hyperalimentation. JAMA. 8 mars 1976;235(10):1040‑1.
- Silvis SE, Paragas PD. Paresthesias, weakness, seizures, and hypophosphatemia in patients receiving hyperalimentation. Gastroenterology. avr 1972;62(4):513‑20.
- Kameoka N, Iga J ichi, Tamaru M, Tominaga T, Kubo H, Watanabe SY, et al. Risk factors for refeeding hypophosphatemia in Japanese inpatients with anorexia nervosa. Int J Eat Disord. avr 2016;49(4):402‑6.
- Sundström N, Brorsson C, Karlsson M, Wiklund U, Koskinen LOD. Refeeding syndrome: multimodal monitoring and clinical manifestation of an internal severe neurotrauma. J Clin Monit Comput. mai 2021;35(3):569‑76.
Cas clinique
Historique :
La patiente de 39 ans, souffrant d'anorexie sévère avec un poids de 28 kg pour 1m68 (IMC 9.9 Kg/m2), a été retrouvée inconsciente par son conjoint (score de Glasgow GCS3). Elle a été vue pour la dernière fois à 18h, se plaignant de bouffées de chaleur et de malaise, avant de s'allonger. Dix minutes plus tard, elle a été retrouvée inconsciente. Il n'existe pas de notion de fièvre, de troubles digestifs ou respiratoires, de convulsions, de prise de substances toxiques connue, ni de traumatisme signalé. Par contre, le conjoint signale qu’elle avait augmenté sa consommation alimentaire depuis 24 heures.
À l'arrivée du SMUR :
- Conscience : GCS 3 (coma profond)
- Fréquence cardiaque : 155 bpm
- Tension artérielle : Imprenable, absence de pouls radial
- Saturation en oxygène : Imprenable
- Température corporelle : Hypothermie à 33°C
- Signes neurologiques : Mydriase bilatérale réactive
- Auscultations : Cardio-pulmonaire et abdominale normales
Interventions et évolution :
- Resucrage avec G10% et 2 Ampoules de G30%, améliorant la glycémie à 1.8 g/L et l'état neurologique (GCS passant à 9 avec Y4V1M4), apparition d'un regard pendulaire et d'une agitation motrice.
- Support hémodynamique : Remplissage vasculaire avec 1L25 de NaCl en 1h, suivi d'un bolus d'éphédrine (3 mg) puis d'un relais par noradrénaline à 0.1 gamma/kg/min.
- Sédation : Administration de kétamine (20 mg x 2) en réponse à l'agitation.
- Imagerie : BodyTDM ne montre pas d'anomalies majeures, sauf des condensations pulmonaires bi-basales.
Le tableau clinique de cette patiente de 39 ans souffrant d'anorexie sévère présente plusieurs éléments suggestifs d'un diagnostic de syndrome de renutrition inappropriée (refeeding syndrome), SRI).
1. Historique d'anorexie sévère et récente et d'augmentation de la prise alimentaire :
- Le SRI se produit chez les patients ayant une malnutrition chronique, comme l'anorexie mentale qui reprennent volontairement ou au décours d'une hospitalisation une alimentation.
- La reprise alimentaire n'a pas besoin d'être très importante pour provoquer un SRI.
2. Symptômes neurologiques et cardiovasculaires graves : ils sont à l'origine des décès (mort subite, choc cardiogénique, hypoglycémie, oedème cérébral)
- L'altération de la conscience avec un score de Glasgow de 3, puis une amélioration partielle après resucrage, suggère une hypoglycémie initiale qui est un signe précoce de SRI conséquence d'une sécrétion inadapatée d'insuline en réponse avec l'absorption glucidique.
- L'instabilité hémodynamique traduit l'aggravation rapide de déséquilibre électrolytique préexistant (hypophosphatémie, hypokaliémie ou hypomagnésémie) par transfert intracellulaire soit par hyperinsulinisme soit par reprise de l'anabolisme cellulaire.
- L'hypothermie (33°C) est un symptôme de malnutrition sévère plus que du SRI.
Points de réflexion
Le SRI peut survenir pour une renutrition modérée et représenter d'emblée une mise en jeu du pronostic vital. Il sera d'autant plus sévère que l'état de dénutrition est avancé. La renutrition de ces patients doit commencer dans le cadre d'une hospitalisation en secteur de surveillance continue. Très fréquemment en hospitalisation, l'état de dénutrition est sous-estimée conduisant à une renutrition trop rapide à l'origine du SRI.
Admission en Médecine Intensive et Réanimation (MIR) :
- Fréquence cardiaque : 97 bpm
- Tension artérielle : 108/78 mmHg après l’arrêt de la noradrénaline à l’arrivée
- Saturation en oxygène : 95 % sous O₂ à 3 L/min
- Température corporelle : Hypothermie à 33,4 °C
- État de conscience : Score de Glasgow (GCS) à 8
- Signes neurologiques : Regard pendulaire, Babinski bilatéral
- Auscultation : Cardio-pulmonaire et abdominale normales.
Bilan biologique à l’admission :
- Kaliémie : 3,75 mmol/L [Normale : 3,4-4,5]
- Phosphorémie : 0,89 mmol/L [Normale : 0,84-1,45]
- Magnésémie : 0,72 mmol/L [Normale : 0,66-1,07]
- Calcémie corrigée : 1,90 mmol/L [Normale : 2,15-2,55]
Évolution :
- Reprise de conscience normale durant la nuit. Somnolence persistante.
- Sevrage des vasopresseurs à l'arrivée puis stabilité tensionnelle.
- Au niveau biologique :
- épisodes d’hypoglycémie sur les premières 24 heures,
- administration continue de G10 %.
- Supplémentation en thiamine
- Forte fluctuation en phosphore +/- potassium avec apports importants.
A J3, décision de transfert en Soins Intensifs de gastro-entérologie. Apparition d'une confusion en début d'après-midi puis 2 heures plus tard épisodes convulsifs se répétant sur 2 heures malgré traitement. Réadmission pour EDME.

Points de réflexion
Dans ce cas de figure, l'état de mal épileptique est la conséquence du syndrome de renutrition et plus précisément de l'hypophosphorémie intracellulaire. Les convulsions sont des complications classiques bien que rare car touchant les cas extrêmes de dénutrition. Dans notre cas, la phosphorémie plasmatique (0,45 mmol/L) reflète l'hypophosphorémie intracellulaire, mais cette corrélation peut être absente n'écartant pas le diagnostic.
Il faut noter plusieurs maladresses dans la gestion de cette patiente :
- l'utilisation d'insuline lors d'hyperglycémie est à proscrire. Cette hyperglycémie n'est que la résultante transitoire d'un resucrage et l'administration d'insuline ne peut qu'aggraver l'hyperinsulisme inadaptée du RSI.
- l'administration de la nutrition entérale suit les recommandations en commençant à faible niveau calorique avec augmentation progressive mais devrait être administrée sur 24 heures pour diminuer la fréquence des hypoglycémies. L'administration nocturne avait été proposée pour pallier le problème technique d'un débit insuffisant sur 24h conduisant à une coagulation du produit de nutrition dans la sonde gastrique. Il suffit d'ajouter de l'eau en Y pour résoudre le problème.
- l'adjonction de sérum glucosé 10% aux apports hydro-électrolytiques journaliers pour limiter le risque d'hypoglycémie (par analogie avec l'acidocétose diabétique) est une très mauvaise solution et à probablement conduit à la complication épileptique. En augmentant l'apport calorique au delà des recommandations, la balance apport/consommation d'électrolytes notamment en phosphore est déséquilibée et aggrave le risque de carence intracellulaire symptomatique.
- Le resucrage en cas de besoin se fera ponctuellement par G30% IV en cas de symptômes cliniques ou mieux en absence de symptômes par un bolus d'alimentation entérale de 5 à 10 ml.
L'évolution de l'EDME est favorable après 24 heures de sédation par propofol/sufentanyl et Lévétiracétam 500 mg x 2/jour.
La patiente présente un réveil adapté, une réponse aux ordres simples à la fin du deuxième jour de ventilation. Un passage en VS AI 7 cmH2O, peep 5 cmH2O.
Les paramètres de ventilation montrent une fréquence respiratoire (FR) à 22 c/mn, un volume courant (Vt) à 400 ml et un volume minute (VM) à 8,8 L pour une FiO2 à 29%.
Le GDS n°1 montre après 6 heures de VS AI :
- pH : 7,63
- pCO2 : 19,7 mmHg
- pO2 : 77,3 mmHg
- HCO3- : 20,7 mmol/L
- Saturation : 96,1 %
- Mactates : 0,8 mmol/L
Dans la nuit, après un GDS similaire, la patiente passe en ventilation d'apnée :
Les paramètres de ventilation montrent une fréquence respiratoire (FR) à 12 c/mn, un volume courant (Vt) à 325 ml et un volume minute (VM) à 3,9 L pour une FiO2 à 21%.
Le GDS n°2 montre :
- pH : 7,43
- pCO2 : 27 mmHg
- pO2 : 111 mmHg
- HCO3- : 17,7 mmol/L
- Saturation : 97,3 %
- Lacates : 0,7 mmol/L
Une tentative de passage en VS AI se solde par une polypnée immédiate à 31 c/mn puis une apnée avec nouveau passage en VC.
La patiente est déconnectée du respirateur et mise sous O2 1,5 L/mn. Au bout d'une heure, la saturation reste à 99% et la patiente est extubée avec succès.
Le GDS n°3 montre :
- pH : 7,35
- pCO2 : 33 mmHg
- pO2 : 168 mmHg
- HCO3- : 18,3 mmol/L
- Saturation : 97,4 %
- Lactates : 0,5 mmol/L
Points de réflexion
Il ne faut pas analyser la polypnée de cette patiente comme un signe de détresse ou d'épuisement respiratoire conséquence d'une extrême sarcopénie. Le SRI s'accompagne d'une polypnée superficielle avec alcalose ventilatoire en réponse à une diminution d'apport d'oxygène au niveau cellulaire et à une acidose métabolique (acidocétose de jeûne).
En VS AI, le GDS n°1 montrent une sur-assistance avec alcalose respiratoire qui fini par entrainer des apnées et le déclenchement du mode de secours. En effet, le volume ventilatoire nécessaire au transport de l'O2 rapporté au poids de 28 Kg de cette patiente est abaissé probablement entre 3 et 3,5 L/mn.
En VC, la fréquence est imposée à la patiente et permet une baisse du VM et de la FR, diminuant l'alcalose ventilatoire.
Le plus simple pour limiter cette sur-assistance était donc de diminuer l'assistance soit en baissant ou stoppant l'AI soit plus simplement par une épreuve de déconnexion.
Date de dernière mise à jour : 29/08/2024